Изменяя внешние условия, мы можем получить одно из трёх агрегатных состояний. Для металла, который не испытывает аллотропических превращений, т.е. существует с одной упаковкой атомов в твердом состоянии эту зависимость можно изобразить графически (рис.1).
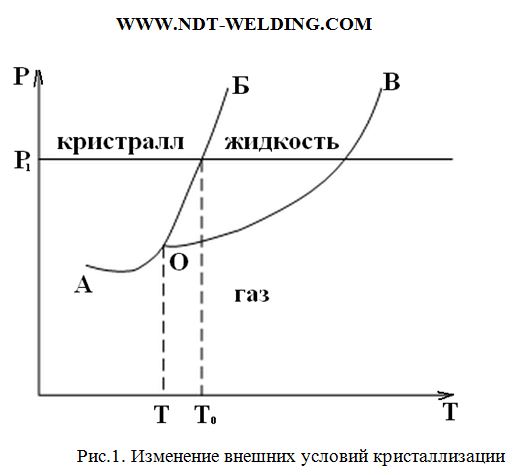
Ni, Cr, Cu – эти металлы не испытывают полиморфных превращений.
При постоянном давлении p1=const, при T0 в равновесии находятся кристаллическое тело и жидкий раствор, т. е. две фазы находятся в равновесии.
Фаза – однородная часть системы, обладающая одинаковыми химическими и физическими свойствами и имеющая поверхность раздела.
Внутренняя энергия неупорядоченной жидкости должна быть выше в случае упорядоченного твердого тела и при переходе из одного состояния в другое должно наблюдаться выделение или поглощение тепла.
Теплота, выделяющаяся при переходе жидкой фазы в твёрдое состояние называют скрытой теплотой плавления «L».
Установим связь между температурой кристаллизации и скрытой теплотой плавления. При температуре кристаллизации жидкая и твердая фаза обладают равными энергиями, способными произвести внешнюю работу, т.е. Gl = Gs
Gl – свободная энергия Гиббса в жидкости, Gs – свободная энергия твёрдой фазы. Эту величину называют термодинамическим потенциалом. В отличие от свободной энергии Гельмгольца -F=E – TS, свободная энергия может быть определена:
G=E-TS+pV
где Е – внутренняя энергия системы, TS – связанная энергия системы, S – энтропия, p– давление, V – объём.
Именно из-за изменения энтропии при переходе жидкого состояния в твёрдое, можно установить связь между теплотой плавления и температурой кристаллизации.
Энтальпию фазы можно определить: H=E+pV
Свободная энергия:
G=H-TS
При T0 :
HL-HS=T0SL-T0SS=T0ΔS
HL-T0SL=HS-T0SS
Разница энтальпий (теплосодержаний) – это и есть скрытая теплота плавления, т. е. L=Hl-Hs
Подставляем в вышеприведенную формулу и получим:
L=TEΔS или ΔS=L/Te
Таким образом мера изменения степени порядка при переходе жидкой фазы в твёрдую может быть получена частным от деления скрытой теплоты плавления на температуру кристаллизации.
При образовании кристаллов с упаковкой ОЦК, ГЦК, ГП из расплава степень изменения энтропии практически одинакова.
В реальных условиях при температуре равновесия никогда не начинается процесс кристаллизации. Для начала процесса кристаллизации необходимо всегда переохлаждение. Наглядно представлено на кривой кристаллизации сурьмы (рис.2).
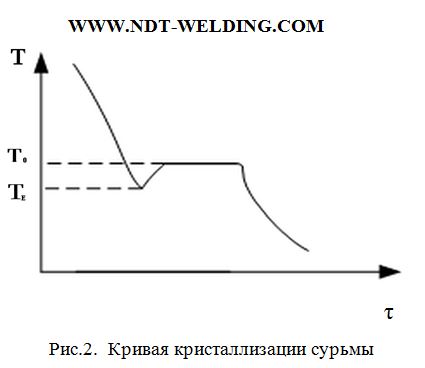
Когда жидкость находится при температуре ниже TЕ, говорят, что жидкость находится в переохлажденном состоянии. Как только кристаллизация началась, температура оставшейся жидкости быстро повышается до нормальной температуры кристаллизации вследствие выделения скрытой теплоты плавления.
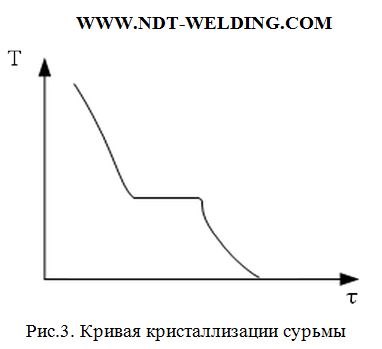
При кристаллизации небольшого количества металла, выделившейся теплоты может оказаться недостаточно, чтобы поднять температуру до равновесной и тогда кристаллизация будет иметь следующий вид (рис.3.)
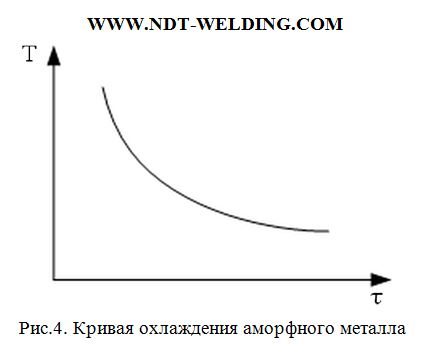
Если тело при кристаллизации оказывается аморфным, не связанным с изменением степени порядка, скрытая теплота не выделяется и кривая кристаллизации имеет следующий вид (рис.4.)
Разница между температурой равновесия и истинной температурой начала кристаллизации называют степенью переохлаждения.
